曾經締造全球第一例“三親嬰兒”的美國華裔醫生張進,最近收到了來自美國食品及藥物管理局(FDA)的警告信。警告信提醒他,在尚未獲得資質前,宣傳線粒體移植法的療效是違法的。而且,目前看來,張進暫時沒有希望開展相關臨床試驗。
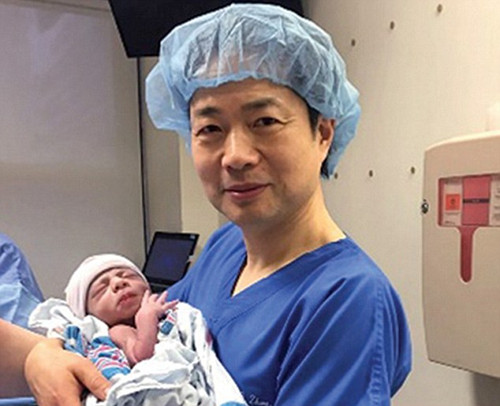
張進醫生抱著5個月大的哈山。美國中文網圖
曾經締造全球第一例“三親嬰兒”的美國華裔醫生張進,最近收到了來自美國食品及藥物管理局(FDA)的警告信。警告信提醒他,在尚未獲得資質前,宣傳線粒體移植法的療效是違法的。而且,目前看來,張進暫時沒有希望開展相關臨床試驗。
今年6月,《麻省理工科技評論》報道稱,美國紐約新希望生殖醫學中心創始人張進已經成立另一家名為“達爾文生命(Darwin Life)”的公司,旨在用線粒體移植法應對高齡產婦的不孕不育問題,費用在每例10萬美元左右。
此舉招來美國食品及藥物管理局的注意,并于8月4日書面致信張進,以提醒達爾文生命公司的官網宣傳不符合相關規定。
8月17日,澎湃新聞(www.thepaper.cn)試圖打開達爾文生命公司官網,但網站已經全面下線。
美國食品及藥物管理局在信中透露,2016年4月,在使用線粒體移植法,幫助一位患有嚴重線粒體疾病的中東女性在墨西哥產下世界首位“三親嬰兒”后,張進向FDA提交了書面請求,希望進行新藥臨床試驗申請前咨詢(Pre-IND Meeting, PIND),以便開展圍繞“用線粒體移植法進行線粒體疾病患者輔助生育”的臨床試驗。在為患者提供該技術前,張進需要通過臨床試驗,證明技術的有效性、安全性。
所謂線粒體移植法,是將患者卵子中的線粒體移除,補充上來自健康捐贈者的線粒體。在和精子完成授精后,形成的胚胎含有三個人的遺傳物質。

FDA警告信的部分內容
但美國食品及藥物管理局表示,他們拒絕了張進的這個書面申請。自2015年12月起,美國國會要求FDA,不再受理涉及修改人類胚胎基因的新藥臨床試驗申請。而張進的線粒體移植法所生成的,正是經過人為修改的胚胎。
在收到美國食品及藥物管理局的“拒信”后,張進回復FDA稱,在得到有效的新藥臨床試驗許可之前,達爾文生命公司將不會在美國境內開展線粒體移植試驗。
盡管有張進的書面承諾,但在FDA看來,達爾文生命公司網站上的一些介紹內容,仍在大力宣傳線粒體移植如何使得高齡女性的卵子變得年輕、幫助患有線粒體疾病的女性生育健康后代,這是有違相關規定的。
美國現行法律允許實驗室范圍內進行胚胎基因修改實驗,但不允許將經人為修改的胚胎放入子宮發育。為了完成首例“三親嬰兒”,張進是在美國完成線粒體移植步驟后,轉至沒有明確禁令的墨西哥,將胚胎著床于中東女性子宮內。在墨西哥,新希望生殖醫學中心有診所開設。張進因完成首例“三親嬰兒”被選為《自然》2016年度十大科學人物。
據澎湃新聞了解,在完成首例“三親嬰兒”后,張進就考慮將這技術拓展到更大范圍的群體——40歲以上不孕不育的高齡女性。張進認為,高齡女性之所以懷孕幾率低,和其卵子線粒體的活性降低有關。
2016年11月,在接受澎湃新聞專訪時,張進曾透露,下一步想研究能不能利用該技術治療高齡婦女的不孕不育問題,讓她們的卵子年輕化,能夠生育。
截至發稿前,張進尚未回復澎湃新聞的詢問。